2022年,集采可能延伸到中藥和生物藥,地方醫保目錄增補出清,重點監控和基藥目錄進行調整,DRG/DIP全面啟動,biotech轉型,醫保控費進入深水區,中國醫藥産業将不斷升級...
一、控費:進入深水區
1、集采:注射劑挑大梁、中藥/生物藥是關鍵
2021年10月8日國務院深化醫改領導小組發布的《關于深入推廣福建省三明市經驗 深化醫藥衛生體制改革的實施意見》(以下簡稱《意見》)要求,2022年集采要完成300個品種,前五批已完成了218個(不納入第六批胰島素),則2022年至少要完成82個品種的國采。
按前五批平均每批44個品種推算,2022年還要進行兩批國采,盡管2021年已嘗試了中藥和生物藥(第六批國采專項集采了胰島素,湖北、廣東集采了中成藥),但2022年會否擴大到中藥、生物藥仍是懸念。
但注射劑将成為集采主流已無懸念,前四批主要集采的是非注射劑型,截至目前,已過評的金額大、競争充分的非注射劑大多已被集采,因注射劑一緻性評價的正式規則于2020年5月14号才出台,所以很多剛過評的注射劑尚未集采。
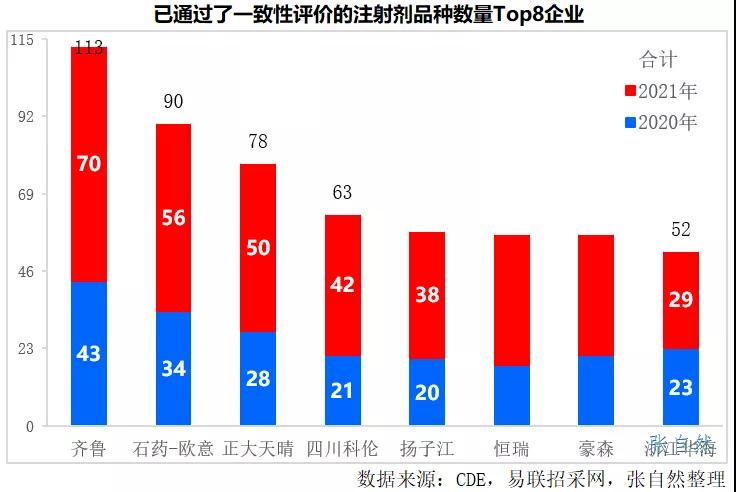
2021年有775個注射劑過評,其中,過評品種數最多的企業依次是齊魯、石藥歐意、正大天晴集團、四川科倫和揚子江等知名大型企業,其在2021年過評的注射劑品種數分别為70個、56個、50個、42個和38個。
此外,地方集采也不可小視。《意見》鼓勵以省為單位或建立省際聯盟以及加入“三明采購聯盟”進行集采。
地方集采對品類的要求相對寬松,也不受化藥一緻性評價的限制,中藥(青海、金華、濮陽、湖北19省聯盟、廣東6省聯盟)、生物藥(武漢首試胰島素集采)、未過評的化藥都可進行集采,且數量也無規律可言,地方集采更是“防不勝防”。
2、醫保:地補出清
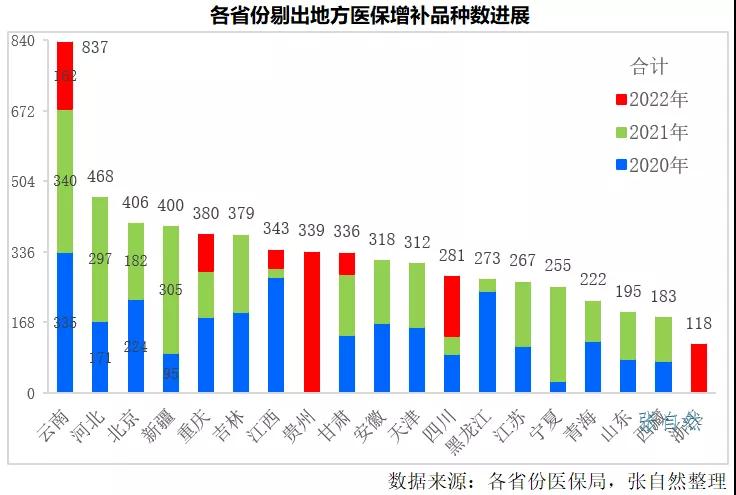
2019年9月26日,國家醫保局在武漢舉辦的醫藥服務管理培訓上确定省級增補的醫保目錄
藥品在三年内(2020-2022)分别按各省增補數量的40%、40%、20%進行廢除,2022是最後一年,所有仍留在地方醫保的品種必須全部剔除出醫保,相關企業将遇重大挑戰。
這些品種多數都屬獨家,且是不少企業的當家産品,一旦被剔除,除做好臨床價值研究外,隻能開辟自費和院外市場。
3、DRG/DIP:從試點到推開
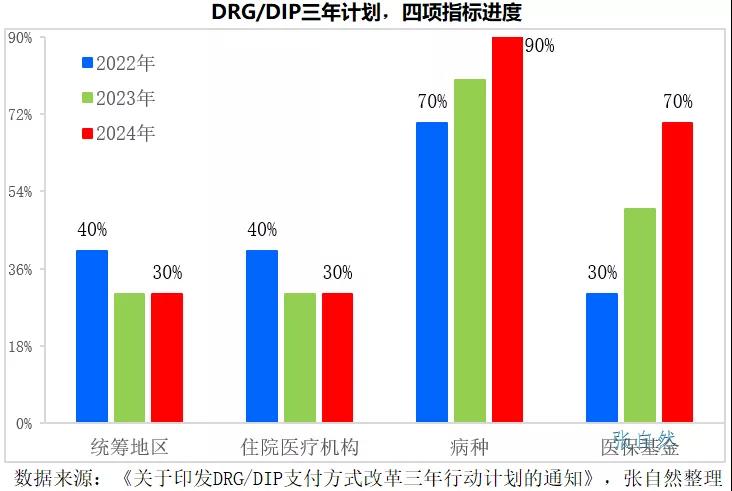
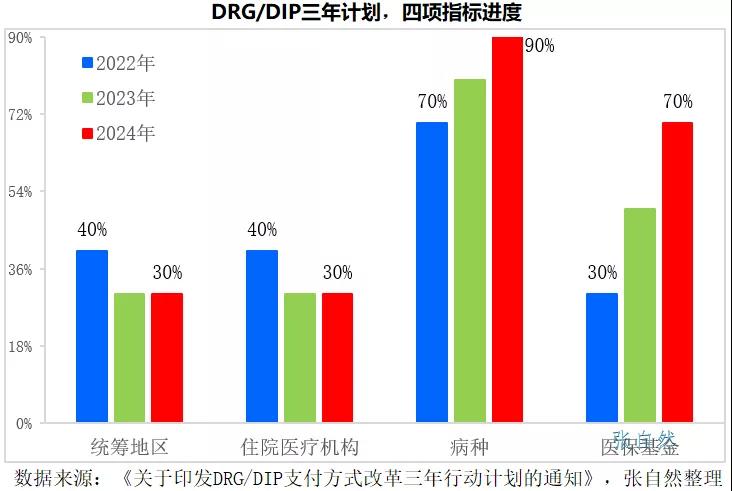
2021年11月16号發布的《國家醫療保障局關于印發DRG/DIP支付方式改革三年行動計劃的通知》要求,到2024年底,全國所有統籌地區全部開展DRG/DIP付費方式改革工作。
DRG/DIP支付方式改革到2024年底對統籌地區、醫療機構、病種和醫保基金的覆蓋率要分别達到100%、100%、90%和70%。
2022年是三年規劃的開局之年,實施DRG後,醫院出于自負盈虧的考量,會優先使用性價比高的藥品,性價比低的藥品将被大幅弱化,手術用藥和住院藥物的處方将要面臨嚴格控制。
4、重點監控:擴容
2021年9月3日發布的《關于印發國家重點監控合理用藥藥品目錄調整工作規程的通知》明确,重點監控和合理用藥目錄每3年一調整,上一版是2019年7月發布的,到2022年正好滿三年,新版除由原來的20個增加到30個外,還劃定了遴選範圍,即不合理問題較多、使用金額異常偏高、對用藥合理性影響較大的化學藥品和生物制品将被納入目錄。
納入的品種主要包括輔助用藥、抗腫瘤藥物、抗微生物藥物、質子泵抑制劑、糖皮質激素和腸外營養藥物等,進了該目錄,除會被踢出醫保外,在臨床上也會被邊緣化。
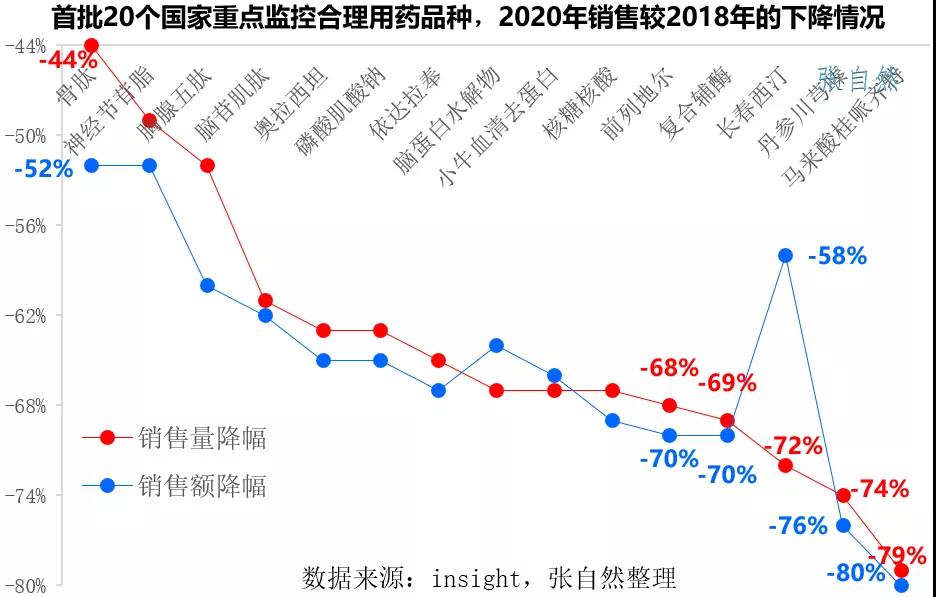
此前首批納入的20個品種銷售都遭遇了大幅下滑,下圖展示了部分重點監控品種2020年銷售額與2018年的比較,無論是銷售額還是銷售量都全部被腰斬,其中馬來酸桂哌齊特的銷售額和銷售量都下降了八成。
5、基藥調整
2021年11月15日,國家衛健委發布《國家基本藥物目錄管理辦法(修訂草案)》,要求對含瀕危
藥材、滋補保健、國家重點監控目錄、非臨床治療首選等品種都不得納入目錄,新納入品種的依據是疾病譜變化、藥品不良反應監測評價、藥品使用監測和臨床綜合評價和已上市藥品循證醫學、藥物經濟學評價等。
2021年12月2日,相關部門又為此在京召開了座談會,明确增設兒童藥品目錄,更加突出基藥的臨床價值,主管部門也正在篩選适應中國國情的指南,作為目錄制定的參考。
基藥目錄的影響一度弱化,現又不斷增強,2019年10月11日發布的《關于進一步做好短缺藥品保供穩價工作的意見》要求基層、二級、三級公立醫院基藥配備品種數量占比原則上分别不低于90%、80%、60%。
二、創新:國際接軌
1、biotech 轉型
近年來,由于政策鼓勵和資本追逐,誕生了一批biotech(研發型生物科技公司),大大推動了我國
醫藥産業的轉型升級,但研發内卷、賽道擁擠,審評審批政策和證券市場也都提高了門檻,這些
企業同時也面臨産品商業化的挑戰。
水大魚大的同時,行業也正在不斷分化。有的成功上市(主要經港交所18A和科創版)、有的被并購、有的強強聯合,也不乏正向biopharma躍升者。
biotech的前景備受行業尤其投資者關注,但具體前景如何尚難準确預測,中國醫藥企業管理協會王學恭課題組進行了專題研究,發現目前中國的研發生物技術公司總體數量在2000家左右。
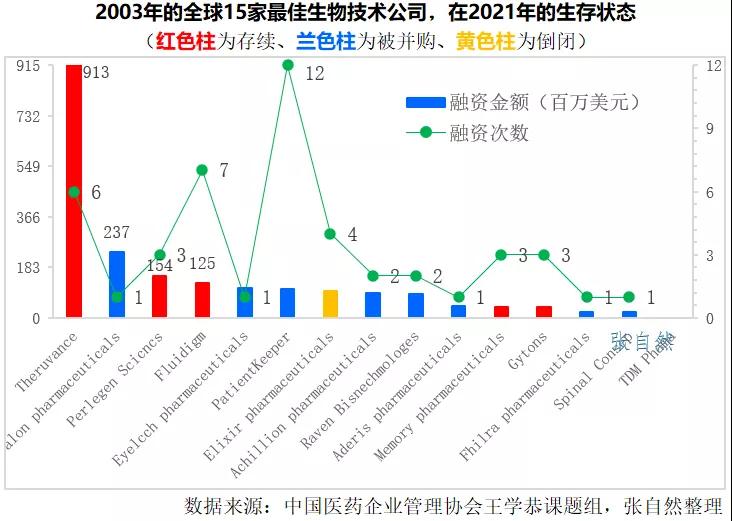
通過問卷調查,多數觀點認為,Biotech成功轉型Biopharma的僅占10%。同時通過對Fierce pharma于2003年評選出的15家最佳生物技術公司進行跟蹤研究發現,到2021年,這15家公司中,有9家被并購、1家倒閉,隻有5家存續。
2、出海
在控費大背景下,不但帶量采購大幅降價,醫保談判每次也多被腰斬,而企業要盡快賺回研發成本和出于企業天職的利潤最大化考量,不得不将眼界放寬到全球。
縱觀世界排名靠前的大型藥企無一是獨守本土市場而不面向全球拓展的,由于體制不同,美國不但是醫藥市場規模最大的而且也是藥品定價最高的,所以許多跨國藥企在美國的銷售額都占到了公司總銷售額的近一半。
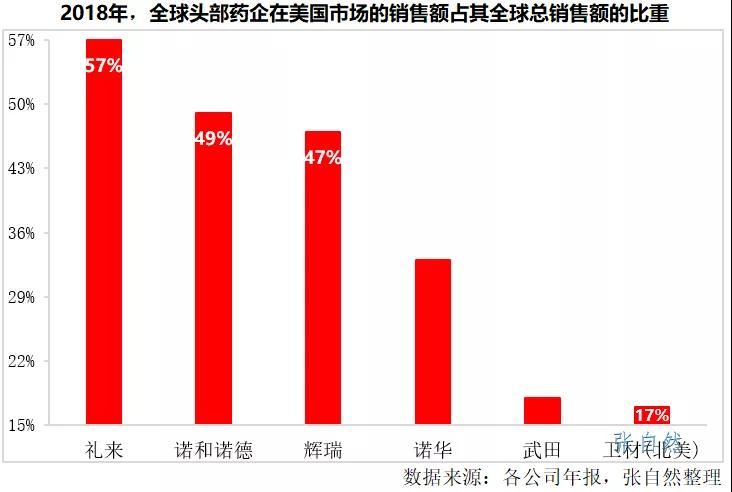
以2018年為例,禮來、諾和諾德、輝瑞在美國市場的銷售額就分别占到了其公司總銷售額的57%、49%和47%,即使一向保守的日本藥企在美國的銷售也占了其公司總銷售額的近1/5,如武田占了18%、衛材(北美)占了17%。
3、源頭創新
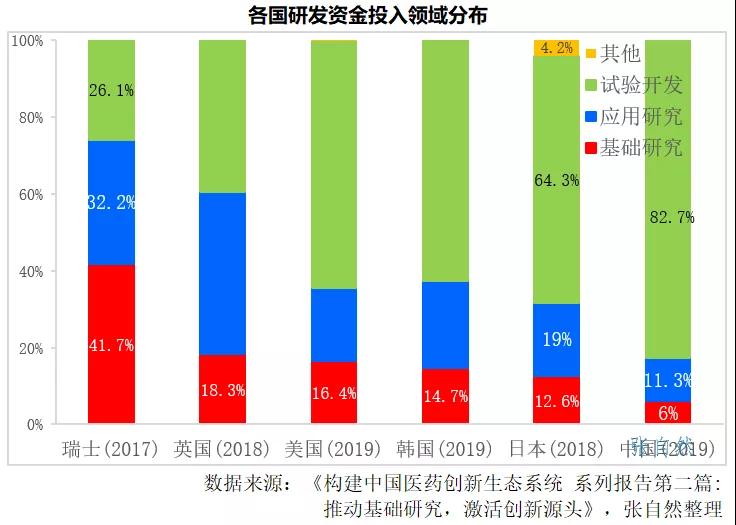
近年來,我國的醫藥創新發展迅速,但仍以跟随式高仿為主,原創的東西較少,主要是我國基礎研究氛圍和投入都不足,如2019年我國用于基礎研究的資金僅占研發總投入的6%,而瑞士(2017)、英國(2018)、美國(2019)、韓國(2019)和日本(2018)則分别占到了41.7%、18.3%、16.4%、14.7%和12.6%,目前的研發内卷也是體現,證券市場也已敲響了警鐘,加強源頭創新才能提高競争力。
三、中藥:蓄勢待發
1、重點監控擴容:免躺槍
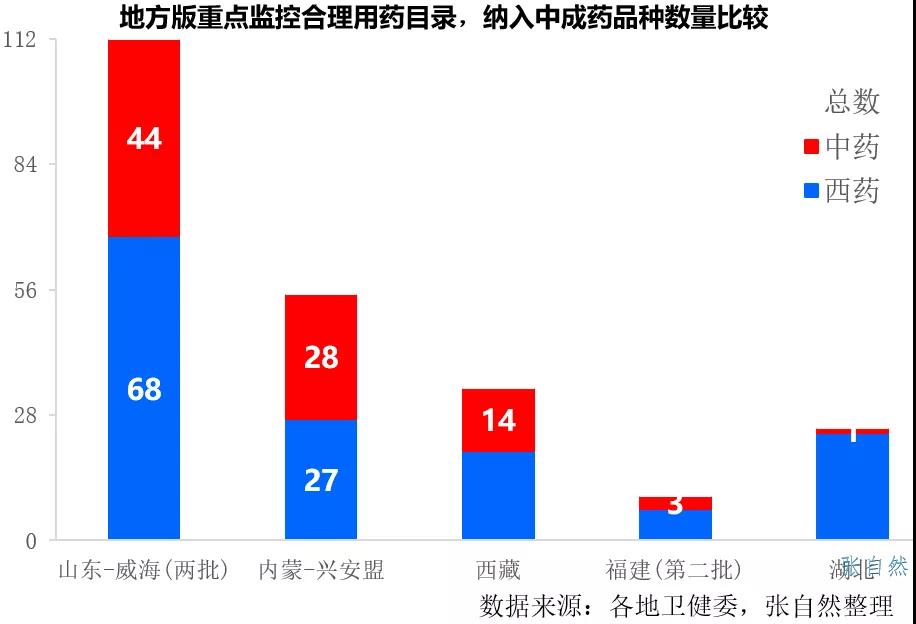
2022年重點監控合理用藥目錄将進行調整,盡管隻納入西藥并不涉及中藥,但現行的首批重點監控目錄在2019年7月發布時也不涉及中藥,但後來地方版很多還是納入了中藥。
如山東威海、内蒙古興安盟和西藏等都分别納入了44個、28個和14個中藥,福建第二版重點監控納入了3個中藥,分别是複方丹參滴丸、麝香通心滴丸、腦心通膠囊等最著名的中藥品種。
所以2022年的重點監控目錄調整盡管也不涉及中藥,但由于重點監控概念的再次廣泛滲透,屆時地方版會否仍納入中藥需謹慎關注。
2、基藥調整:寄厚望
自2009年我國實施基本藥物制度以來,基本藥物經曆了先快速發展又逐漸回落的過程,由于近年不斷出台鼓勵政策,基本藥物又恢複發展,在臨床的使用頻度和金額方面都明顯上升,如二、三級
醫院的使用頻度占比分别由2018年的38.7%、33.7%提升到了2020年第二季度的56%和51%,使用金額占比分别由2018年的17.9%、12.6%提升到了2020年第二季度的32%和26%。
基本藥物目錄已經過2012年和2018年兩次擴容,由2009版的102個,增加到了2012和2018版的203個、685個,中藥在基藥目錄總數的占比也由2009版的33%,分别提升到了39.04%和39.12%,2022年基藥目錄又将調整,樂見有更多中藥被納入,也為振興中藥産業的發展提升一份信心。
确保醫保基金長期可持續是底線,騰籠換鳥是方向,帶量采購仍是突破口,出海和基礎研究是創新的不竭源泉。